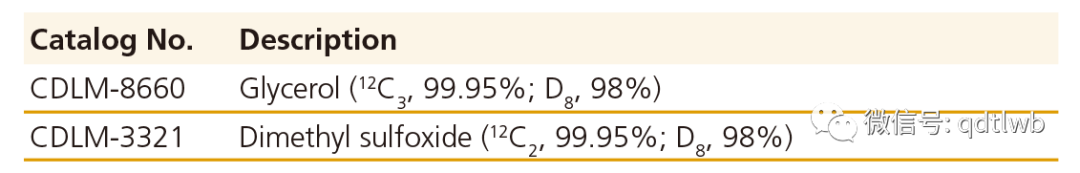青岛腾龙微波科技有限公司
您身边的实验室专家

更新时间:2021-06-01 10:05:01
磁共振领域的诸多发展都是为了提高灵敏度,人们可以将核磁共振波谱的固有的低灵敏度归咎于磁诱导的核自旋态之间非常小的粒子数差异。这些粒子数差异的程度(也称为极化程度)通常由玻尔兹曼分布决定,并与磁场强度、温度和被观测核的旋磁比有关。最近出现了一些方法,它们将核极化从高极化物种转移到感兴趣的核上,从而使极化程度大大超出玻尔兹曼分布所允许的范围。这些方法被称为超极化方法,与热平衡时相比,可能会导致信号强度显著增加104倍。
对于有机分子,两种常用的超极化方法是动态核极化(DNP)和对氢诱导极化(PHIP)。使用这些技术获得的极大提高的灵敏度可以大大降低检测限度,从而增加了磁共振检测痕量成分的功率。更大的信噪比(SNR)也可以允许快速、顺序的光谱采集,因此非常适合于研究许多不同的化学和生化过程的动力学。
动态核极化(DNP)
DNP是由未配对电子的极化转移到研究中的原子核而促进的溶解。DNP方法要求样品在强磁场(如3t)中微波辐照时保持低温(如<4k)辐照后,样品用热加压溶剂迅速溶解,并转移到核磁共振管或注射注射器中,以便立即进行核磁共振或核磁共振数据采集。在微波辐射期间,样品中必须存在浓度为mM的自由基掺杂剂(例如,“OX63”和“Finland”等三苯基自由基),以便为分子间转移提供所需的核极化。一般来说,可接受的极化水平是通过几十分钟到几个小时的辐照时间来实现的。
仲氢诱导极化(PHIP)
PHIP将极化直接从对氢(para-H2)转移到附近感兴趣的核或使用射频基磁化转移方法。对于有机分子,对h2可以直接通过不饱和碳-碳键加入,也可以在极化可以从para-H2转移到分子内位的条件下与样品混合。与DNP相比,PHIP的一些优点是可以很快获得极化样品(在秒或分钟的量级上),并且不需要自由基掺杂剂。
代谢成像
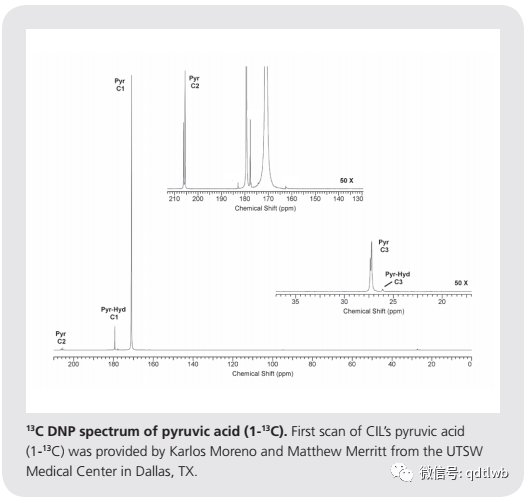
使用DNP和PHIP获得的信号增强可以用于检测体内1H、13C和15N代谢。使用超极化13C富集有机分子的13C磁共振成像(MRI)比基于1h的成像技术具有显著优势,因为剔除了背景信号的影响,13C的化学位移范围使分子选择性增加。目前,人们将同位素富集的超极化底物用于医学成像,因为可以获得详细的代谢信息(底物定位和生化转化)和生理信息(例如,细胞内pH值)。人们对使用1-13C丙酮酸作为DNP底物,根据其转化为乳酸来区分健康组织和病变组织。虽然超极化自旋半核的信号增强随着T1衰减,研究人员正在建立长寿命的核状态,有望在几分钟甚至几小时的时间尺度上研究新陈代谢,而不是几秒。
超极化富集底物
CIL提供以下超极化富集底物,用于代谢研究以及PHIP和DNP实验。由于消除了13C-1H偶极弛豫,邻近13C核的氘的存在可能有助于延长T1时间。研究显示,其中一个或多个化合物超极化在同一个样本,从而同时探测多种途径。


超极化气体
3He和129Xe是用光泵方法超极化的,这些材料用于核磁共振成像来显示肺部的气流空间和阻塞。一种新的生物传感器,包括封装129Xe的发展也是一个活跃的研究领域。
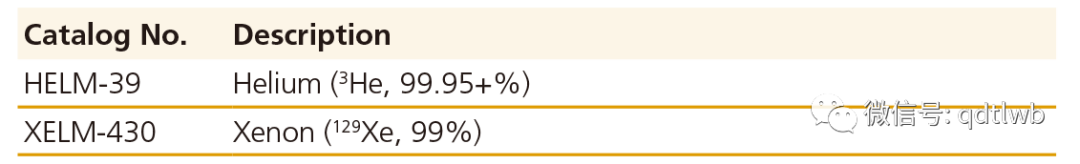
用于DNP的氘化溶剂
对于DNP实验,在微波辐射期间和之后使用氘化溶剂有助于降低核弛豫速率,从而延长13C核和其他核超极化的时间。极化过程中使用的所有溶剂必须在低温下玻璃化,以确保自由基均匀地分散在固体样品中。

贫13C氘化溶剂
在固态低温条件下获得的DNP实验得益于连续微波辐照,因此可以进行未经修饰的固态核磁共振实验(如CPMAS 2D实验)。使用贫13C的氘化溶剂将大大减少或消除溶剂中不需要的13C信号,从而提高获得的光谱质量。